Científicos de la UGR fabrican chips inyectables en óvulos para medir etapas tempranas del desarrollo
El dispositivo, que funciona como sensor mecánico, es extremadamente minúsculo: mide apenas 22 por 10,5 micrómetros, tiene un grosor de 25 nanómetros
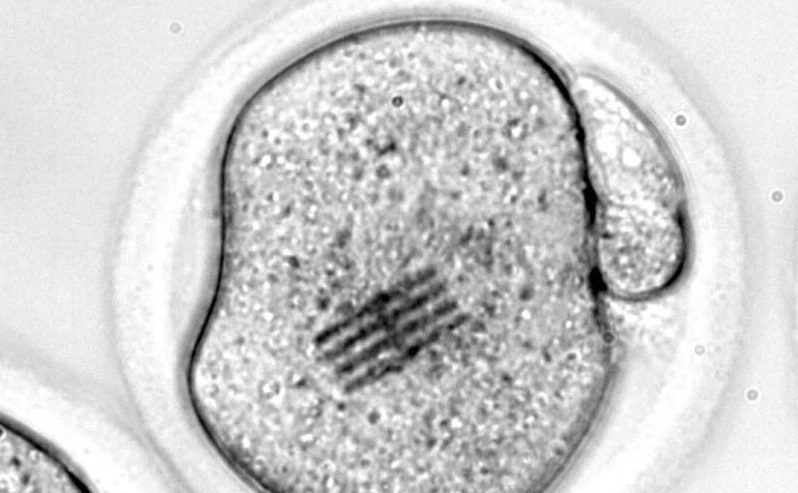
Un equipo de investigadores en el que participa la Universidad de Granada (UGR) ha fabricado unos chips que ha introducido dentro de células vivas, concretamente en óvulos, para detectar los cambios mecánicos que se producen en las etapas tempranas del desarrollo embrionario.
Los científicos han inyectado el chip en el interior de un óvulo de ratón junto con un espermatozoide para estudiar las etapas iniciales de la fertilización, según detalla en una nota la UGR.
El dispositivo, que funciona como sensor mecánico, es extremadamente minúsculo: mide apenas 22 por 10,5 micrómetros, tiene un grosor de 25 nanómetros (tres veces menor que el de un virus como el SARS-CoV-2) y una longitud 3 veces más pequeña que el diámetro de un cabello humano.
Con el chip dentro, los científicos han podido medir las fuerzas que reorganizan el interior del óvulo, es decir, su citoplasma, desde que se introduce el espermatozoide hasta que se divide en dos células.
"Haciendo un símil con el baile, el embrión realiza una coreografía de movimientos durante su desarrollo y hemos visto que no solo el movimiento es importante sino también la intensidad del mismo", comentan los investigadores.
Los trabajos para inyectar el chip en ratones se han llevado a cabo en el Laboratorio de Embriología Molecular de Mamíferos de la Universidad de Bath (Reino Unido).
La investigación es novedosa porque la detección de estas fuerzas se ha realizado de manera directa, esto es, desde el interior del embrión y a lo largo de todo el proceso inicial de fertilización.
"Casi todos los trabajos realizados hasta la fecha usan herramientas externas, obteniendo una medida indirecta y si lo hacen desde el interior es de una forma muy local y no describen la reorganización del citoplasma", apuntan los autores.
Así, los científicos han hecho una medida preliminar de las fuerzas que se obtienen en la reprogramación del ADN del espermatozoide, algo que sucede justo tras la inyección del espermatozoide.
"Aunque es muy difícil de comparar, hemos visto que estas fuerzas son mayores que las que otros grupos han medido en células musculares", señalan los investigadores.
También se ha observado que el efecto de la membrana del embrión, que es más rígida que su interior, es la responsable de que los pronúcleos (núcleos que transportan el material genético de la hembra y del macho) converjan en el centro del embrión para fusionarse.
Durante la fusión, no se han detectado fuerzas. Esto podría ser así, dicen los científicos, porque de esa forma se facilita la reorganización de los cromosomas.
DIVISIÓN EN DOS CÉLULAS
La siguiente etapa es la división de la primera célula en dos. Aquí, los científicos han visto cambios en la rigidez del citoplasma. "En este momento, nuestros chips revelan que el citoplasma se hace más rígido, hecho que facilitaría la transmisión de las fuerzas dentro del embrión para conseguir elongarse", señalan los autores. Esta elongación es necesaria para la posterior división en dos células.
Después, en el momento en que la célula se divide en dos, el citoplasma es menos rígido, posiblemente para facilitar la división.
Este trabajo de investigación básica es un trabajo conceptual que demuestra la viabilidad del sensor mecánico en el interior de una célula.
Se sabe que las fuerzas mecánicas que se dan en la célula tienen importantes implicaciones biológicas, pero no era algo que se hubiera podido medir durante todo el proceso inicial de fertilización hasta la fecha y de forma detallada.
Asimismo, ha sido posible el estudio fundamental de los primeros estadios del proceso de fertilización, comprobando que la mecánica del embrión de ratón es similar a la de los embriones humanos en su fase inicial.
Por tanto, los resultados de este trabajo pueden tener interés tanto para la medicina de fertilización como para el estudio de enfermedades relacionadas con malformaciones en los procesos iniciales de formación del embrión.














